Oxalate Ferrique LOT 207341 - Préparation pour le KallitypeL'Oxalate Ferrique en solution pour le procédé Kallitype peut être obtenu de plusieurs façons.
La quasi totalité des Oxalates Ferriques de bonne qualité disponibles sur le marché, qu'ils soient Anhydres, Dihydratés, Pentahydratés ou Hexahydratés, fonctionnent. Il suffira simplement de comprendre la notion de masse moléculaire pour en adapter les proportions et de jouer sur la petite quantité d'ajout d'Acide Oxalique pour dissoudre et éliminer les traces de sels Ferreux nocifs en Photographie.
Dans cet article, nous allons uniquement nous attacher à la préparation de la solution par l'Oxalate Ferrique sous forme cristal, proposé sur la Boutique en ligne et correspondant au lot 207341 inscrit sur l'étiquette de votre pot d'Oxalate Ferrique.
En effet, chaque lot d'Oxalate Ferrique cristal demande un ajustement de l'ajout d'une petite proportion d'Acide Oxalique afin d'assurer une dissolution maximale de la substance active.
L'Oxalate Ferrique demande aussi qu'on le débarrasse de ses traces de sels Ferreux nocifs à la pratique Photographique, par l'ajout d'une seconde quantité d'Acide Oxalique.
Certains lots ne demandent pas d'ajout d'Acide Oxalique pour la mise en solution alors que d'autres auront besoin d'une petite proportion (de 0 à 4gr pour 100ml).
L'Oxalate Ferrique sous forme cristal est très stable dans le temps, se conserve plusieurs années, mais reste une substance assez peu constante dans sa fabrication et surtout, à la base, non formulée pour les pratiques Photographiques. Même si il s'agit bien de sels Ferriques, une petite quantité de sels Ferreux nocifs à nos besoins sont toujours présents.
Nos besoins en Photographie nécessitent un Oxalate Ferrique totalement débarrassé de ses quelques traces de sels Ferreux qui engendrent le voile chimique dans les blancs du papier. C'est le rôle d'un second ajout d'Acide Oxalique et d'Eau Oxygénée.
En résumé, de façon claire, les étapes sont les suivantes :
- 1) Mise en solution de l'Oxalate Ferrique cristral avec ou sans une petite proportion d'Acide Oxalique pour aider la dissolution (0 à 2gr pour 100ml) Pour le lot 207341 : AUCUN AJOUT.
- 2) En fin de dissolution, ajout d'une proportion donnée d'Acide Oxalique pour le traitement des sels Ferreux. - 3) Repos/Maturation de 48h - 4) Filtration - 5) Ajout d'une quantité donnée d'Eau Oxygénée
- Repos de 24h à 48h Dans toute méthode de fabrication de l'Oxalate Ferrique, le but essentiel est d'obtenir une concentration suffisante et d'éviter les sels Ferreux qui donnent du voile.
Les manipulations sont simples, voyons-les à présent en images et en détail :
Nous allons préparer ici 50ml d'Oxalate Ferrique à environ 20% pour le procédé Kallitype.
Nous avons choisi 20% dans cet exemple, mais il existe plusieurs sources de concentrations différentes à ce sujet. En pratique, il y a peu de différences, c'est très souple, mais ce sera à vous de choisir ce qu'il vous semblera comme être la meilleure concentration pour votre pratique personnelle même si il est assez difficile au final de dicerner de réelles différences. Il faudra bien-sûr adapter les proportions.
Nous aurons besoin au total de :
- Eau déminéralisée 50ml - Oxalate Ferrique 10gr (LOT 207341) - Acide Oxalique 2gr - Eau Oxygénée à 30% 10 gouttes ou à 9% 30 gouttes ATTENTION : Cette solution peut également convenir pour le procédé au Platine/Palladium. Cependant, pour ce dernier, une saturation en Acide Oxalique se révèle être bénéfique. Voir la préparation de l'Oxalate Ferrique (lot 207341 uniquement) dédiée, ici : http://www.disactis-photochimie.fr/PBCPPlayer.asp?ID=2345091
 Préparation :
Dans un bécher, pesez simplement 10 gr d'Oxalate Ferrique, puis complétez avec de l'eau déminéralisée pour atteindre le volume de 50ml.
C'est ici que la notion de "dissolution difficile" prend tout son sens. En effet, un agitateur magnétique chauffant vous sera d'une aide précieuse. Grâce à lui, la mise en solution de l'Oxalate Ferrique demandera entre 45mn et une heure d'agitation entre 40 et 50°c. Si pour seuls alliés vous n'avez qu'une baguette d'agitation en verre, de l'huile de coude et un bain marie maintenu entre 40 et 50°c, ceci pourra vous prendre quelques heures, et à froid, plusieurs jours ! Il est important, enfin, de ne pas dépasser la température de 50°c afin d'éviter la dégradation de la substance active.
1) MISE EN SOLUTION
Après 15mn d'agitation entre 40 et 50°c, l'Oxalate Ferrique commence à se dissoudre et à passer en solution.
La couleur passe du vert au jaune.
Il faut être patient...   Au bout de 45mn à une heure, la solution paraîtra plus limpide, d'une couleur jaune/marron sombre.
Il sera toujours possibles que quelques particules non dissoutes subsistent. Ceci engendrera un léger dépôt au fond du bécher, dont la quantité demeurera négligeable et sera éliminée à l'étape de la fitlration. 2) AJOUT D'ACIDE OXALIQUE / TRAITEMENT DES SELS FERREUX
Lorsque la solution est estimée être à son maximum en terme de dissolution des sels, coupez l'alimentation du système de chauffe, ralentissez la vitesse d'agitation, et ajoutez 2gr d'Acide Oxalique.
L'agitation doit durer juste le temps de la dissoultion complète de l'Acide Oxalique. L'Acide Oxalique ici ajouté, tiendra un rôle majeur dans l'élimination des sels Ferreux.
Sa quantité minimale est également importante. En effet, l'Acide Oxalique en trop grande quantité dans la solution réagirait ultérieurement avec le Nitrate d'Argent pour produir un Oxalate d'Argent insolluble. Il est donc impératif de ne pas en ajouter trop.
 3) MATURATION - La solution d'Oxalate Ferrique dans cet état, n'est pas encore utilisable. L'Acide Oxalique a besoin d'un certain temps pour mener à terme la réaction attendue de presque totale neutralisation des sels Ferreux indésirables.
Pour ce faire, abandonnez pendant 48 à 72h la solution dans un endroit obscur et tempéré. Il est important de préserver la solution de la lumière. Après ces 48 à 72h de repos, un léger dépôt s'est formé au fond du bécher (ce dépôt commence dès la première minute de repos). Il s'agit en majeure partie d'Acide Oxalique ayant emporté des composés Ferreux et les particules non dissoutes.
La quantité d'Oxalate Ferrique d'origine n'a par conséquent que très peu varié. La solution par transparence, s'est éclairçie et sa couleur est passée au jaune/vert.  4) FILTRATION
Filtrez la solution afin d'éliminer les résidus indésirables.
Cette étape est très importante, ne l'omettez jamais !
De manière générale en Photographie, la filtration des solutions est souvent la clé pour éliminer de nombreux problèmes de pollution aux particules.
Un filtre à vitesse moyenne suffit. Choisissez un flacon à large ouverture ou un autre bécher. Cette grande ouverture sera un point utile pour la suite des opérations (élimination du gaz C02). 5) AJOUT D'EAU OXYGENEE
Nous allons à présent apporter la touche finale à la préparation.
Pour ces 50ml d'Oxalate Ferrique, ajoutez 10 gouttes d'Eau Oxygénée à 30% ou 30 gouttes à 9%.
Nous pourrions nous contenter de nous arrêter à l'étape précédente, cependant, il peut subsister encore quelques traces de sels Ferreux dans la solution qui peuvent ensuite engendrer des blancs légérement voilés sur le papier.
Les très exigeants préfèreront toujours des blancs parfaits, et c'est compréhensible. L'Eau Oxygénée va jouer ce rôle d'oxydation instantannée des sels résiduels.
Nous pourrions nous contenter de laisser l'Acide Oxalique continuer seul son travail, mais l'Oxygène que nous allons apporter directement dans la solution va provoquer le coup de grâce.
(Anecdote : Ce phénomène de passage des ions Ferreux à Ferriques a lieu lui-même dans la nature et se trouve favorisé dans les plans et les cours d'eau très oxygénés.)  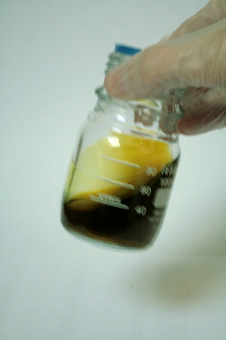 Agitez tranquillement le tout afin d'activer la réaction dans toute la solution d'Oxalate Ferrique.
Instantanément, la solution à l'origine marron sombre s'est éclaircie et offre à présent une teinte jaune/verte plus agréable. Une petite effervescence peut se produire.
Il s'agit du résultat d'une réaction entre l'Acide Oxalique et l'Oxygène. Lors du mélange, l'Eau Oxygénée vient neutraliser une partie de l'Acide Oxalique libre en libérant du Dioxyde de Carbone. Ce gaz ainsi que l'Oxygène en excès pouvant augmenter le contraste des images, doivent s'échapper de la solution et c'est pourquoi il faudra à nouveau abandonner la solution au repos pendant un jour ou deux, à l'air libre (flacon ouvert) et à l'abri de la lumière. Cette étape de repose est donc très importante également !
Ceci fait, la solution est prête à l'emploi. Stockez votre Oxalate Ferrique dans un petit flacon brun.
Une dernière précision : Les Solutions d'Oxalate Ferrique n'étant que peu stables dans le temps, c'est à dire parfois trois mois ou parfois un peu plus, il est sage de ne préparer que la quantité dont on aura besoin pour les séances de travail prévues pour les semaines suivantes.
 Problèmes possibles : Si un léger voile chimique apparaît (hors voile physique de lumière donc) lors de vos premiers tests, celui-si peut avoir plusieurs origines :
- Un papier inadapté
- Une pollution chimique imprévue (Outils souillés lors des préparations) ou chimies de développement polluées.
Si ces éléments sont écartés, il faudra alors refaire une solution d'Oxalate Ferrique en augmentant légèrement la proportion d'Acide Oxalique pour l'élimination des sels Ferreux. Dans cet exemple, passer de 2gr à 2,5gr ou 3gr et surtout bien respecter les temps de repos.
Pour toute autre question ou difficulté rencontrée, n'hesitez à utiliser le Forum de Discussion : https://disactis.com/forum/index.php |
